Impacto de la Pupilometría en la evaluación neurológica
El reflejo pupilar ha sido parte en la valoración oftalmológica, optométrica y neurológica, gracias a sus bases neuronales y a la relevante información que puede brindar no solo del estado funcional del sistema visual sino de información no visual 1.
Lina Fernanda Gama¹, Yuli Natalia Franco¹, Sandra-Carolina Durán Cristiano²
¹Estudiantes IX Semestre de Optometría. Universidad de la Salle
²Docente Facultad Ciencias de la Salud, Universidad de la Salle.
Esto último, se debe a la actividad de las células ganglionares intrínsicamente fotosensibles (ipRGCs) por sus siglas en inglés, quienes han sido análisis en neurodiagnóstico, de manera especial en la enfermedad del Alzheimer, trastornos afectivos, trauma craneoencefálico, neurotoxicidad y en glaucoma, siendo esta una de las principales causas de ceguera a nivel mundial (Figura 1) 2.
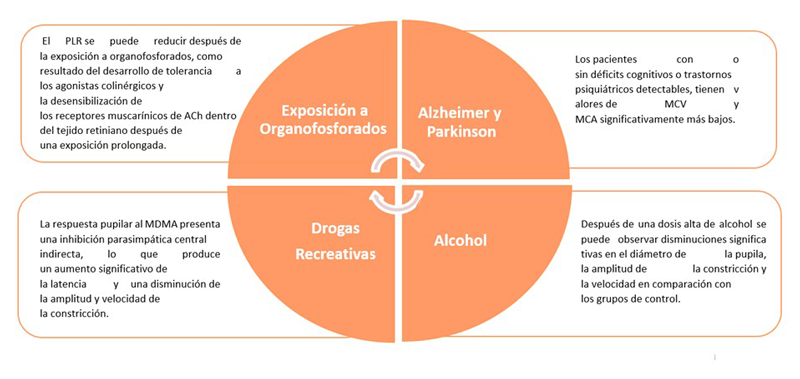
Figura 1. En la gráfica se evidencia la importancia clínica que tiene el reflejo pupilar a la luz, como herramienta de apoyo clínico para diversas condiciones clínicas. MCV: Velocidad máxima de constricción. MCA: Amplitud de constricción máxima. RCA: Amplitud de constricción relativa. Ach: Acetilcolina.
Las células ganglionares intrínsicamente fotosensibles, fueron descritas a finales de los 90, no obstante, a partir del 2005, mediante análisis experimentales demostraron que es un tipo particular de célula ganglionar, alrededor del 5% de todas las células ganglionares que pueden ser activadas frente a un estímulo luminoso y que particularmente expresan un fotopigmento llamado melanopsina 3,4. Interesantemente, las ipRGGCs una vez estimuladas, transducen la señal hacia áreas de la vía retino-geniculo-cortical y una gran parte de las fibras de estas, envían la señal al núcleo olivar pretectal y al hipotálamo hacia el núcleo supraquiasmático modulando funciones de regulación del ritmo circadiano y el reflejo pupilar a la luz (PLR) 2,5. En efecto, existe una gran evidencia, que demuestra que cambio en la actividad de dichas células en enfermedades como el glaucoma, producen una respuesta alterada a la luz y alteraciones en el sueño 6.
La contribución de estas células sobre enfermedades del sistema nervioso ha llamado la atención de los investigadores en las últimas décadas, por lo cual, muchos experimentos en el área de la neurociencia abordan neuropatologías para evaluar in vivo las ipRGCs mediante pupilometría 7.
¿Y por qué la pupilometría? Como se había mencionado anteriormente, las ipRCGs envían señales hacia el núcleo pretectal olivar en cerebro medio y regulan la contracción de la pupila transitoria. En efecto, análisis in vitro en modelos animales, encontraron que las ipRGCs se activan cuando reciben estimulo luminoso particularmente en longitudes de onda de 470 nm a 480 nm (luz azul) 4,8. Por lo tanto, la evaluación por pupilometría y particularmente la pupilometría cromática brinda información relevante de la actividad de este fotorreceptor intrínseco.
En la función del PLR, que establece el equilibrio entre la sensibilidad visual y la resolución espacial mediado por el tamaña pupilar para que la información luminosa sea transmitida e interpretada juegan un papel importante los fotoreceptores, de manera especial las ipRGCs. En efecto, Keenan et al, demostraron que, al eliminar el gen de la melanopsina, se abolía la actividad de las ipRGCs y como resultado se generaba respuesta pupilar a la luz anormal 9. Por lo tanto, análisis en diversos modelos empezaron a incluir dentro de esta evaluación neurológica la pupilometría no solo por la información autonómica que se podía obtener de dicha respuesta sino por la asociación con eventos biológicos como la fotoregulación del reloj circadiano 1,10.
Gracias al desarrollo tecnológico aplicado a la salud visual, en la actualidad, se pueden encontrar en el mercado una variedad de equipos para el análisis de pupilometría, en este sentido, se han identificado análisis mediante pupilometría automatizada infrarroja con estímulos monocromáticos y cromáticos en busca de la evaluación de las ipRGCs, siendo esta una gran herramienta frente a otras pruebas de diagnóstico neurológico, como la neuroimagen que es más costosa y con un mayor grado de invasividad 11. De igual manera, algunos autores respaldan una correlación clínica entre cambios en la respuesta del PLR y alteraciones corticales en individuos con enfermedad de Alzheimer, esclerosis múltiple, deterioro cognitivo, depresión y glaucoma, lo cual sugiere que la pupilometría podría ser incluida como parte de la evaluación neurológica en investigaciones y en la práctica clínica12.
En la última década, la definición de glaucoma ha sido modificada, teniendo en cuenta la comprensión de los eventos biológicos implicados en la enfermedad, por lo tanto, actualmente se define como una enfermedad neurodegenerativa que puede estar asociado o no al aumento de la presión intraocular (PIO) y que induce de manera irreversible, apoptosis de las células ganglionares de la retina 13. Desde el punto de vista clínico, pruebas como la campimetría, tomografía de coherencia óptica (OCT), sensibilidad al contraste han sido aplicadas en el diagnóstico y seguimiento de la enfermedad. No obstante, algunas investigaciones ponen en evidencia que la pupilometría pueden ser una herramienta de apoyo diagnostico para la detección temprana de la enfermedad y en efecto, Vidal, demostraron que individuos con glaucoma pueden presentar alteraciones en las ipRGCs asociado a una PLR anómala y a cambios en el ritmo circadiano 14,15.
En resumen, la pupilometría es una novedosa fuente de diagnóstico no invasiva, que podría brindar una valiosa información de la actividad del fotorreceptor intrínseco y que ha sido el objetivo de muchas investigaciones por su aporte en procesos fisiológicos no visuales y en ese sentido, se hace necesario conocer más sobre la fisiología y bioquímica de la fototransducción de las ipRGCs para ser aplicado en la investigación clínica como indicador del funcionamiento del sistema nervioso.
Referencias:
(1) La Morgia, C.; Carelli, V.; Carbonelli, M. Melanopsin Retinal Ganglion Cells and Pupil: Clinical Implications for Neuro-Ophthalmology . Frontiers in Neurology . 2018, p 1047.
(2) Hall, C. A.; Chilcott, R. P. Eyeing up the Future of the Pupillary Light Reflex in Neurodiagnostics. Diagnostics (Basel, Switzerland) 2018, 8 (1), 19. https://doi.org/10.3390/diagnostics8010019.
(3) Lax, P.; Ortuño-Lizarán, I.; Maneu, V.; Vidal-Sanz, M.; Cuenca, N. Photosensitive Melanopsin-Containing Retinal Ganglion Cells in Health and Disease: Implications for Circadian Rhythms. Int. J. Mol. Sci. 2019, 20 (13). https://doi.org/10.3390/ijms20133164.
(4) Do, M. T. H. Melanopsin and the Intrinsically Photosensitive Retinal Ganglion Cells: Biophysics to Behavior. Neuron 2019, 104 (2), 205–226. https://doi.org/10.1016/j.neuron.2019.07.016.
(5) Lynch, G. Using Pupillometry to Assess the Atypical Pupillary Light Reflex and LC-Ne System in ASD. Behav. Sci. (Basel). 2018, 8 (11). https://doi.org/10.3390/bs8110108.
(6) Gracitelli, C. P. B.; Duque-Chica, G. L.; Moura, A. L. de A.; Roizenblatt, M.; Nagy, B. V; de Melo, G. R.; Borba, P. D.; Teixeira, S. H.; Tufik, S.; Ventura, D. F.; Paranhos, A. J. Relationship between Daytime Sleepiness and Intrinsically Photosensitive Retinal Ganglion Cells in Glaucomatous Disease. J. Ophthalmol. 2016, 2016, 5317371. https://doi.org/10.1155/2016/5317371.
(7) Mure, L. S. Intrinsically Photosensitive Retinal Ganglion Cells of the Human Retina . Frontiers in Neurology . 2021, p 300.
(8) Milosavljevic, N.; Storchi, R.; Eleftheriou, C. G.; Colins, A.; Petersen, R. S.; Lucas, R. J. Photoreceptive Retinal Ganglion Cells Control the Information Rate of the Optic Nerve. Proc. Natl. Acad. Sci. 2018, 115 (50), E11817 LP-E11826. https://doi.org/10.1073/pnas.1810701115.
(9) Keenan, W. T.; Rupp, A. C.; Ross, R. A.; Somasundaram, P.; Hiriyanna, S.; Wu, Z.; Badea, T. C.; Robinson, P. R.; Lowell, B. B.; Hattar, S. S. A Visual Circuit Uses Complementary Mechanisms to Support Transient and Sustained Pupil Constriction. Elife 2016, 5. https://doi.org/10.7554/eLife.15392.
(10) Zele, A. J.; Feigl, B.; Smith, S. S.; Markwell, E. L. The Circadian Response of Intrinsically Photosensitive Retinal Ganglion Cells. PLoS One 2011, 6 (3), e17860.
(11) Vassilieva, A.; Olsen, M. H.; Peinkhofer, C.; Knudsen, G. M.; Kondziella, D. Automated Pupillometry to Detect Command Following in Neurological Patients: A Proof-of-Concept Study. PeerJ 2019, 7, e6929–e6929. https://doi.org/10.7717/peerj.6929.
(12) Troiani, V. The Future of Quantitative Pupillometry in Health and Disease. Clin. Auton. Res. 2020, 30 (1), 11–12. https://doi.org/10.1007/s10286-019-00655-3.
(13) Izzotti, A.; Ceccaroli, C.; Longobardi, M. G.; Micale, R. T.; Pulliero, A.; La Maestra, S.; Saccà, S. C. Molecular Damage in Glaucoma: From Anterior to Posterior Eye Segment. The MicroRNA Role. MicroRNA (Shariqah, United Arab Emirates) 2015, 4 (1), 3–17. https://doi.org/10.2174/2211536604666150707124640.
(14) Vidal, K. S. M.; Duque-Chica, G. L.; Nagy, B. V.; Martinez-Madrid, M. J.; Hidalgo, P. A.; Moura, A. L. L. A.; Paranhos, A.; Rol, M. A.; Madrid, J. A.; Ventura, D. F. Evidence of Circadian Biological Rhythm Alterations in Glaucoma Patients. Invest. Ophthalmol. Vis. Sci. 2016, 57 (12), 4664.
(15) Gracitelli, C. P. B.; Duque-Chica, G. L.; Moura, A. L.; Nagy, B. V; de Melo, G. R.; Roizenblatt, M.; Borba, P. D.; Teixeira, S. H.; Ventura, D. F.; Paranhos, A. J. A Positive Association between Intrinsically Photosensitive Retinal Ganglion Cells and Retinal Nerve Fiber Layer Thinning in Glaucoma. Invest. Ophthalmol. Vis. Sci. 2014, 55 (12), 7997–8005. https://doi.org/10.1167/iovs.14-15146.

























