Biocompatibilidad y eficacia antimicrobiana de las soluciones multipropósito para lentes de contacto
Fernando Ballesteros*
Martha Fabiola Rodríguez**
y Mary Fuentes***
* Optómetra MSc Docente Investigador, Universidad de La Salle
** Bacterióloga, MSc Docente Investigador, Universidad de La Salle
***Optómetra, estudiante de Maestría en Ciencias de la Visión, Universidad de La Salle
Los lentes de contacto (LC) representan uno de los biomateriales más utilizados en el mundo, su biocompatibilidad con la córnea depende de la baja fricción in situ, que garantiza un suave movimiento del lente sobre el ojo; no retiene toxinas, microorganismos y otras sustancias que están presentes en el ambiente, y lo más importante, no induce respuestas inflamatorias o inmunológicas en el segmento anterior. El material del lente debe ser suficientemente flexible, especialmente en lentes de mayor espesor, para permitir una comodidad y un desempeño fisiológico satisfactorio.
La permeabilidad al O2 es influenciada por el contenido de agua en los lentes de hidrogel convencional, y en los materiales de hidrogel de silicona, por el agua y el siloxano. Por lo general, cuanto más alto es el contenido de agua y/o siloxano del lente, mayor la permeabilidad al O2. La química del polímero, los métodos de retención de agua, la temperatura, el pH y la tonicidad del medio (lágrimas o soluciones multipropósitos (SMP) para el cuidado de los LC) alrededor del lente, pueden afectar el contenido de agua, como se observa con las soluciones hipertónicas que reducen el contenido de agua, mientras las soluciones hipotónicas lo aumentan. Por ejemplo, los LC con bajo contenido de agua generan menor tinción corneal, y para su mantenimiento se puede utilizar cualquier producto para su cuidado y limpieza; debido al bajo Dk, solamente los lentes más delgados proporcionan suficiente oxígeno para el uso diario. Por el contrario, los LC con alto contenido de agua presentan mayor fragilidad y son más propensos a depósitos.
Los polímeros usados en los LC pueden clasificarse como: iónicos o no iónicos. Los materiales iónicos tienen una carga negativa neta superficial debido a que uno o más componentes del material presentan sus terminales polares negativos hacia fuera; cuantos más grupos polares existen, hay mayor humectabilidad. Acumulan depósitos con más facilidad; cualquier partícula cargada positivamente, como la lisozima, puede ser atraída a sitios con carga negativa de estos materiales. Los materiales no iónicos tienen sitios cargados en la matriz polimérica y como las cargas son internas al polímero, no hay carga neta superficial. Estos LC son menos propensos a depósitos y no unen partículas cargadas. Sin embargo, desnaturalizan más las proteínas lagrimales, son menos humectables, al parecer por la ausencia de grupos polares en la superficie, reduce su atracción para las uniones dipolo con el agua.
El cuidado y mantenimiento es uno de los aspectos más importantes en el uso de LC, ya que influye en el posible éxito durante su uso y la satisfacción del paciente con los lentes. Por esto la elección del régimen de cuidado dependerá de factores, tales como: tipo de lente, material del lente, estilo de vida y necesidades específicas del paciente. La importancia del uso de las SMP radica en evitar la contaminación del LC por los microorganismos, así como la formación de biocapas. Las biocapas o biofilms se refieren a microrganismos adheridos irreversiblemente a un sustrato, embebidas en una matriz, la cual es muy resistente a la destrucción mecánica. Durante el uso, los LC blandos absorben la película lagrimal formando una cubierta rica en proteínas, lípidos, azúcares y otras sustancias que facilitan la adherencia y mantenimiento de los microorganismos. Es así, como los lentes de contacto sirven como sustrato pasivo, pero constante para la adherencia, colonización y crecimiento bacteriano.
Las bacterias más comunes que se encuentran en los LC y estuches, incluyen: Staphylococcus sp, Bacilllus sp, Pseudomona sp y Serratia sp. En los pacientes asintomáticos existen bajos niveles de colonización por bacterias Gram positivas, principalmente Staphylococcus. Los bacilos Gram negativos son los contaminantes más frecuentes de los LC de usuarios sintomáticos (Willcox et al., 2001), particularmente la Pseudomona sp. La capacidad de adherencia de esta bacteria a los LC es 10 veces mayor que la del Staphylococcus. La principal fuente de contaminación de los LC son los estuches, debido a la formación de biofilms y el inapropiado mantenimiento de los lentes por malas condiciones higiénicas.
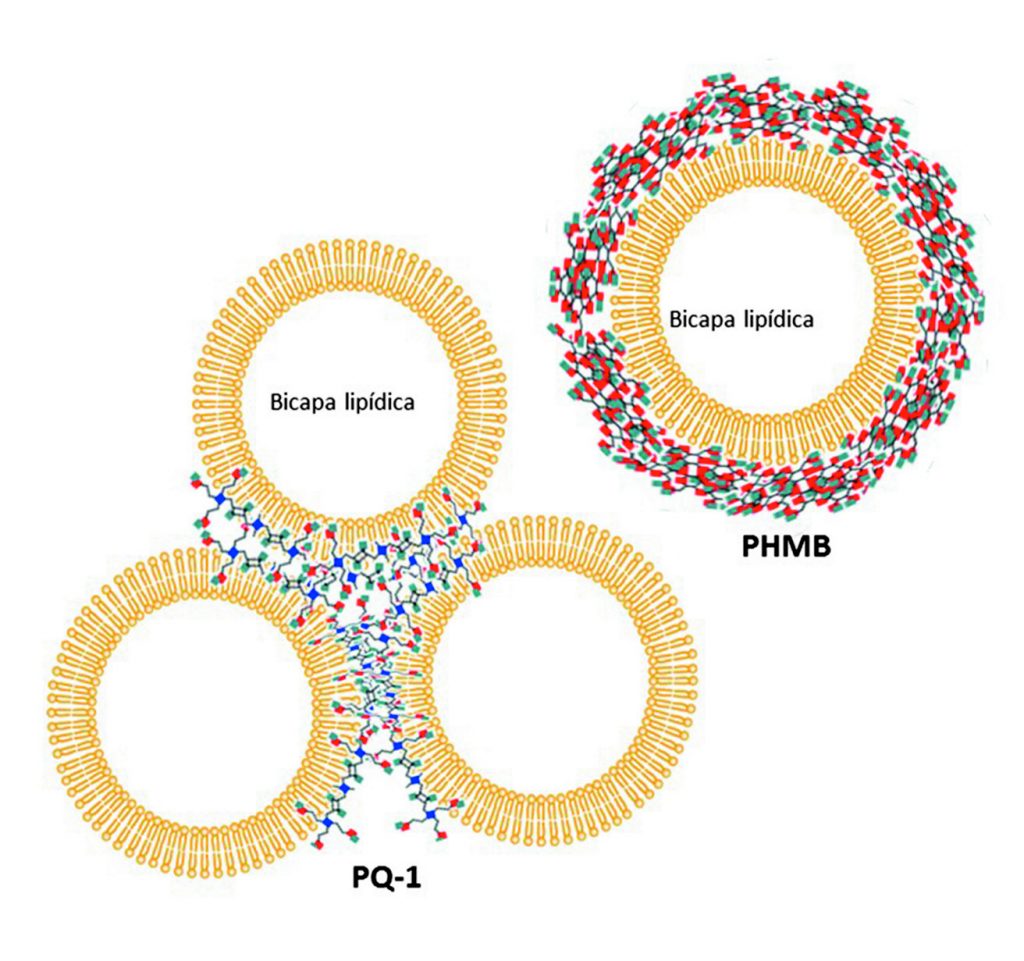
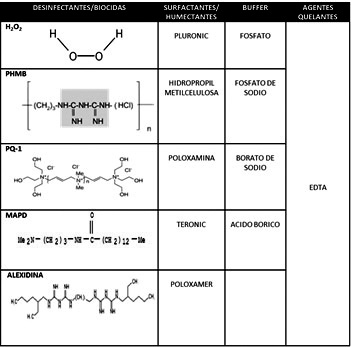
Los agentes desinfectantes o biocidas que actualmente usan las SMP son: peróxido de hidrógeno, Polyhexametilen biguanida (PHMB), Alexidina, Polyquaternarium-1 (PQ-1) y Amidoamina (Aldox) (Szczotka-Flynn et al., 2013). El peróxido de hidrógeno tiene efectos oxidantes, produce iones OH y radicales libres, los cuales atacan a los componentes esenciales de los microorganismos como: lípidos, proteínas y ADN; es tóxico para la córnea y ocasiona disconfort en altas concentraciones. El PHMB, polyhexanide, polyhexidine, Polyaminopropil biguanide (PAPB) o Dymed® interactúa irreversiblemente con la superficie de la membrana celular, sin penetrar, resultando en la pérdida de la permeabilidad selectiva. El PHMB ocasiona la desorganización de los fosfolípidos conduciendo a una mayor fluidez, expansión lateral y permeabilidad de la membrana. Se ha demostrado que la absorción del PHMB a través de las membranas es extraordinariamente rápida, tanto en las bacterias como en las levaduras, consiguiendo un efecto inhibitorio y microbicida a concentraciones de 100mg/ml en 60 minutos (Koburger et al., 2010)”ISBN” : “1460-2091 (Electronic. El PQ-1 es un compuesto de amonio cuaternario que tienen mayor peso molecular que el PHMB, daña las células porque sus cadenas permean la membrana y alteran sus propiedades físicas y bioquímicas; mientras que, el nitrógeno cargado se mantiene en la superficie de la membrana y puede interrumpir la distribución de cargas (figura 1).
Alexidine® es una es una bis-biguanida que difiere químicamente de la clorhexidina al tener grupos terminal etilhexil. Su actividad antibacteriana se basa en interacciones entre las secuencias de biguanida con carga positiva y los fosfolípidos cargados negativamente en la membrana bacteriana. El Myristamidopropyl dimetilamina (MAPD), también denominado Aldox®, es una amido-amina catiónica que tiene actividad anti fúngica y anti protozoaria, principalmente. En las bacterias MAPD se induce daño en la membrana citoplasmática formado burbujas y filtraciones del material celular, a través de las áreas de ruptura.
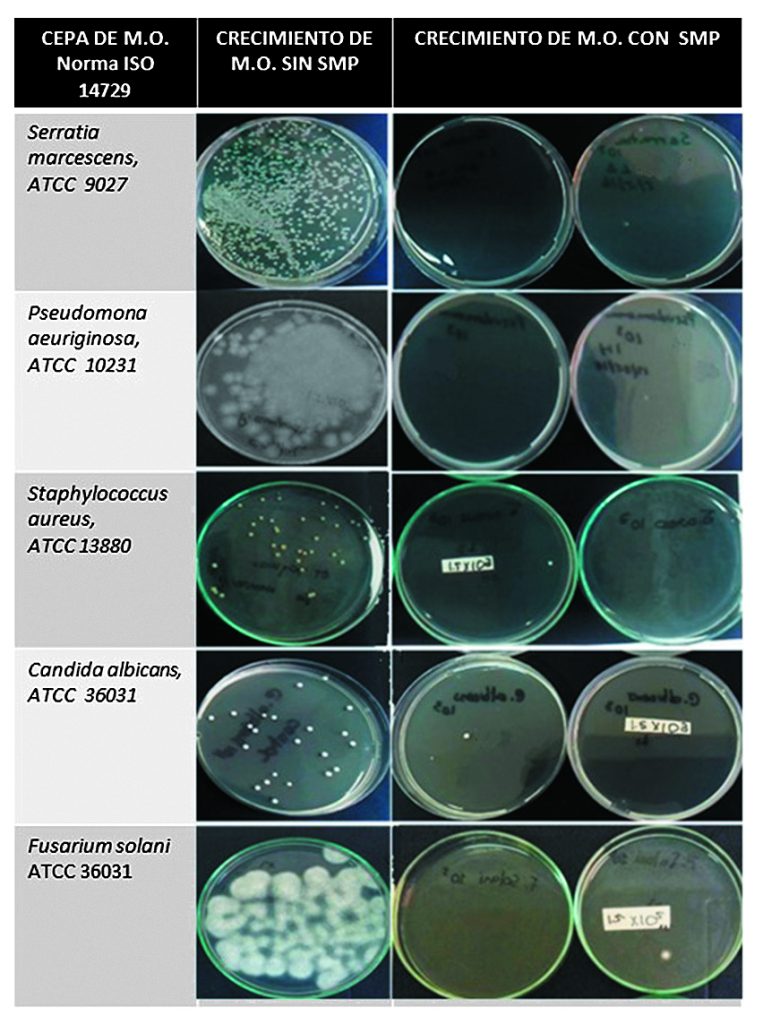
Dado que las SMP no son efectivas para todos los microorganismos, su eficacia antimicrobiana debe ser evaluada frente a los principales contaminantes de LC. Internacionalmente, la norma ISO 14729, Ophthalmic optics contact lens care products microbiological requirements and test methods for products and regimens for hygienimanagement of contact lenses, define los criterios para que la SMP sea comercializada como desinfectante. Las investigaciones que han utilizado esta norma han demostrado a nivel mundial que las SMP que contiene peróxido de hidrogeno, PHMB, PQ-1 y MAPD, son efectivas contra las bacterias Staphylococcus, Pseudomona y Serratia y hongos, Candida y Fusarium (Kilvington et al., 2010; Lever & Borazjanit, 2001). En Colombia, la Universidad de La Salle evaluó la eficacia antimicrobiana de dos SMP producidas en el país, demostrando que las SMP que contienen PHMB, como agente desinfectante, cumplen con los criterios de la norma ISO 14729 para ser una solución desinfectante (Figura 2).
Las SMP también deben ofrecer seguridad y biocompatibilidad para los tejidos de la superficie ocular, para lo cual, además de los agentes desinfectantes o biocidas tienen compuestos que ayudan en la limpieza y a la humectabilidad (surfactantes), a mejorar la eficiencia de la desinfección por secuestro de iones (agentes quelantes) y agentes que dan el pH, tonicidad y osmolaridad (buffers) ideales (Jones & Senchyna, 2007) (tabla 1).
La toxicidad de las SMP se evalúa in vitro en cultivos de células y modelos celulares. In vivo la tinción corneal ha sido la técnica más utilizada para determinar la biocompatibilidad de las SMP con la superficie ocular; además de la evaluación del confort, la película lagrimal y la hiperemia secundaria (Pinto-Fraga et al., 2015). El efecto de las soluciones sobre estos tejidos alcanza su máxima expresión a la hora de la inserción del lente, manteniéndose de dos a cuatro horas, por lo que se recomienda este tiempo para evaluar los cambios fisiológicos en la superficie ocular generados por las SMP (Bandamwar et al., 2010). Otros autores consideran que este tiempo no representa las condiciones reales por lo que recomiendan que estos efectos se midan a las dos semanas, un mes y tres meses (Carnt et al., 2007).
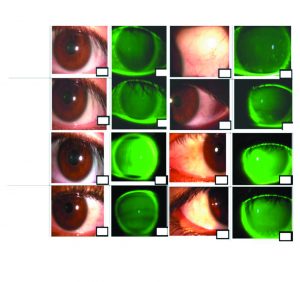
Los estudios sobre el desempeño de las SMP incluyen la combinación de las soluciones y diferentes materiales de LC, ya que dependiendo de la combinación varía la eficacia antimicrobiana y/o la actividad citotóxica de las SMP. Se ha reportado que las soluciones que contienen PHMB ocasionan mayor grado de tinción con los LC balafilcon A (Andrasko & Ryen, 2008) y un menor grado de tinción con LC lotrafilcon B. En general, la mayoría de estudios reportan que el material balafilcon A, genera un incremento significativo en la tinción corneal con todas las SMP. Hubo resultados similares que fueron encontrados en la Universidad de La Salle, en un ensayo clínico cruzado, doble ciego en el cual se evaluó la biocompatiblidad de las SMP, comercializadas y producidas en Colombia con cinco materiales de LC (Senofilcon A, Enfilcon A, Confilcon A, lotrafilcon B y Balafilcon A). Las SMP que contienen PHMB ocasionaron mayor grado de tinción con balafilcona A, sin que éste fuera clínicamente significativo y como en los otros estudios internacionales, todos los sujetos reportaron alto grado de confort sin cambios relevantes en la hiperemia (figura 3).
Las combinaciones de SMP/material del LC pueden causar niveles excesivos de tinción corneal, reducción de los niveles de confort y afectación de la eficacia de la desinfección, por lo que su estudio y evaluación debe ser indispensable para cada nueva solución que sale al mercado. Ninguna SMP es totalmente efectiva en la eliminación de todos los microorganismos y su efecto citotóxico sobre el epitelio corneal; en algunos casos, es inverso a su actividad antimicrobiana. En la actualidad, las SMP son los desinfectantes más prescritos para el cuidado de los LC, con grandes avances en las dos últimas décadas, hoy ofrecen comodidad, confort y una desinfección eficaz a los usuarios de LC.
Referencias bibliográficas
Andrasko, G., & Ryen, K. (2008). Corneal staining and comfort observed with traditional and silicone hydrogel lenses and multipurpose solution combinations, 444–454. http://doi.org/10.1016/j.optm.2008.04.097
Bandamwar, K., Garrett, Q., Cheung, D., Huang, J., Lee, L., Ng, C., & Papas, E. B. (2010). Onset time course of solution induced corneal staining. Contact Lens and Anterior Eye, 33(4), 198–200. http://doi.org/10.1016/j.clae.2010.02.004
Carnt, Willcox, Evans, Naduvilath, Tilia, Papas, Sweeney. Holden, B. (2007). Corneal Staining: The IER Matrix Study. Contact lens spectrum, consultado en http://www.clspectrum.com/articleviewer.aspx?articleid=100843.
Jones, L., & Senchyna, M. (2007). Soft Contact Lens Solutions Review Part 1 : Components of Modern Care Regimens. Optometry in Practice, 8, 45–56.
Horner, I., Kraut, N., Hurst, J., Rook, A., et al. (2015). Effects of Polyhexamethylene Biguanide and Polyquaternium-1 on Phospholipid Bilayer Structure and Dynamics. Journal of physical chemistry, 119(33), 10531-10542.
Kilvington, S., Huang, L., Kao, E., & Powell, C. H. (2010). Development of a new contact lens multipurpose solution: Comparative analysis of microbiological, biological and clinical performance. Journal of Optometry, 3(3), 134–142. http://doi.org/10.1016/S1888-4296(10)70019-4
Koburger, T., Hubner, N. O., Braun, M., Siebert, J., & Kramer, A. (2010). Standardized comparison of antiseptic efficacy of triclosan, PVP-iodine, octenidine dihydrochloride, polyhexanide and chlorhexidine digluconate. Journal of Antimicrobial Chemotherapy, 65(8), 1712–1719. http://doi.org/10.1093/jac/dkq212
Lever, A. M., & Borazjanit, R. N. (2001). Comparative antimicrobial efficacy of multi-purpose hydrogel lens care solutions. Contact Lens and Anterior Eye, 24, 94–99.
Pinto-fraga, J., Blázquez, F., Urbano, R., & González-garcía, M. J. (2015). Evaluation of safety and efficacy of a new multipurpose disinfecting solution on silicone hydrogel contact lenses ଝ. Journal of Optometry, 8(1), 40–47. http://doi.org/10.1016/j.optom.2014.07.004.
Szczotka-Flynn, L., Ahearn, D. G., Barr, J., Benjamin, W. J., Kiang, T., Nichols, J. J., … Winterton, L. (2013). 1. History, evolution, and evolving standards of contact lens care. Contact Lens and Anterior Eye, 36(SUPPL.), S4–S8. http://doi.org/10.1016/S1367-04841360003X
Wessels, S., & Ingmer, H. (2013). Modes of action of three disinfectant active substances: A review. Regulatory Toxicology and Pharmacology, 67(3), 456–467. http://doi.org/10.1016/j.yrtph.2013.09.006
Willcox, M. D. P., Harmis, N., Cowell, B. A., Williams, T., & Holden, B. A. (2001). Bacterial interactions with contact lenses; effects of lens material, lens wear and microbial physiology. Biomaterials, 22(24), 3235–3247. http://doi.org/10.1016/S0142-9612(01)00161-2
Leave a Comment
Lo siento, debes estar conectado para publicar un comentario.





















0 Comments