Cambios visuales, anatómicos y clínicos después de la administración de antioxidantes en la degeneración macular relacionada con la edad (DMRE)
La degeneración macular asociada a la edad (DMAE) es una patología ocular que afecta la mácula, se caracteriza por generar una afección que cursa de manera progresiva con pérdida de la visión central. Afecta principalmente a personas mayores de 50 años, cursa con distorsión de las imágenes y presencia de zonas borrosas en el campo visual central.
MARÍA FERNANDA CÁRDENAS Y NICOOL ROMERO ARIZA
Optómetras
Universidad El Bosque
Los factores asociados son; la edad avanzada, fumar cigarrillo, la predisposición genética, índice de masa corporal alto, hipertensión, género, etnicidad, diabetes, color de iris, colesterol HDL, niveles de triglicéridos entre otros (3). Actualmente existen dos clasificaciones a gran escala de la degeneración macular relacionada a la edad, una es la DMAE seca en la cual se presenta un deterioro de las células del epitelio pigmentario de la retina con ausencia de neovascularización y DMAE húmeda o neovascular donde se van a presentar neovasos a nivel coroideo (4).
Los antioxidantes son muy importantes ya que estos son un mecanismo de defensa celular frente a los radicales libres (ROS), estos pueden actuar de manera directa o indirecta; los antioxidantes directos se caracterizan por ser moléculas pequeñas que tienen propiedades activas redox y por lo tanto tienen la capacidad de eliminar especies reactivas del nitrógeno mientras que los indirectos tienen la posibilidad de ser activos redox o no y estos van a tener la capacidad de regenerar los antioxidantes directos (4).
El estrés oxidativo es un agente causal de gran importancia en la degeneración macular asociada a la edad ya que este se generar por la producción excesiva de radicales libres los cuales van a atacar los fotorreceptores de la retina. Debido a que los conos y los bastones están expuestos a la combinación de la luz y el oxígeno, cuando se presenta este daño el epitelio pigmentario no va a poder disminuir estas moléculas afectadas por lo que estas se van a acumular en la parte basal del epitelio. El propósito para que no se produzca el estrés oxidativo es equilibrar la producción de radicales libres y el número de antioxidantes para así disminuir los efectos nocivos que estos pueden llegar a generar, esto se logra mediante una dieta adecuada (5).
Anatomía retinal
La retina es la parte sensorial del ojo compuesta por fotorreceptores y neuronas que transforman los impulsos luminosos en impulsos eléctricos, que se transmiten a través del nervio óptico, la cintilla y las radiaciones ópticas hasta la corteza visual en el encéfalo y desde aquí hasta la corteza cerebral, donde son interpretados. El nervio óptico atraviesa el agujero óptico junto a la arteria y la vena oftálmicas y se comunica con el cerebro y el sistema nervioso autónomo del ojo. La visión binocular correcta se consigue cuando una imagen se fusiona en la retina tras pasar por la córnea y el cristalino.
Macula
Zona redonda ubicada en el polo posterior, histológicamente el límite convencional de la mácula es la zona que tiene dos o más capas de células ganglionares, mide 5-6 mm de diámetro y ocupa los 15- 20º centrales del campo visual, está centrada verticalmente entre las arcadas vasculares temporales, la porción central de 1,5 mm de diámetro de la mácula ocupada por la fóvea central que por su anatomía y composición de fotorreceptores está especializada en dar la mejor agudeza visual (6).
Los carotenoides son antioxidantes muy abundantes en la retina como la luteína y la zeaxantina (L/Z), se acumulan dentro de la mácula central y dan lugar al color amarillo junto con el isómero meso-zeaxantina se encuentran en el pigmento macular retiniano (MP) en gran proporción y su localización es específica, el isómero meso-zeaxantina está en el epicentro macular, la zeaxantina se encuentra en la media periferia y la luteína periféricamente (7).
La fóvea
Es una depresión de la superficie interna de la retina en el centro de la mácula, tiene un diámetro de 1,5 mm. Dentro de la fóvea hay una región con ausencia de vasos retinianos conocida como zona avascular de la fóvea (ZAF), se considera que el centro geométrico de la ZAF es el centro de la mácula y por tanto el punto de fijación, en la fóvea existe una fosita central que es conocida como fovéola (6).
La fovéola
Esta parte forma el suelo central de la fóvea y tiene un diámetro de 0,35 mm, es la zona más delgada de la retina, carece de células ganglionares y está formada únicamente por un alto número de conos y sus núcleos así como por células de Müller (6).
Anatomía de la coroides
La coroides es un tejido ocular pigmentado que representa el 85% del flujo sanguíneo total del ojo e irriga la parte externa de la retina, forma la cubierta intermedia de la parte posterior del ojo y se localiza desde la ora serrata hasta el nervio óptico, tiene un grosor que puede ir desde 0,1 mm en la parte anterior y 0,22 mm en la parte posterior, la zona más delgada de este tejido se encuentra alrededor de la papila óptica y a medida que se aleja de este sector hacia la coroides peripailar aumenta su grosor (8,9). Se pueden identificar cinco capas histológicamente denominadas:
- Lamina fusca
- Estroma coroideo
- Coriocapilar
- Membrana de Bruch
La coriocapilar se encarga de la nutrición del EPR y de las capas externas retinales dentro de las que se encuentran la capa de fotorreceptores, capa plexiforme externa y la parte externa de la capa nuclear interna. La coriocapilar tiene dos capas vasculares, capa de Haller de grandes vasos y la capa de Sattler con arterias de pequeño y mediano calibre de igual manera arteriolas que alimentan la red capilar y venas (8).
Envejecimiento de la retina y coroides
Los cambios generados por la edad como la arterosclerosis pueden afectar el aclaramiento de las lipoproteínas que se acumulan como drusas, en el envejecimiento varias estructuras pierden su fisiología como los fotorreceptores que se atrofian y al ser encargados de la fagocitosis de desechos retinales en su segmento externo generan perdida de células del EPR y de igual forma en la membrana de Bruch donde hay disminución del grosor y perdida de funciones como el transporte de líquidos y nutrientes, imprescindibles para la función de los fotorreceptores, en la coroides hay una reducción del 50% de grosor en los vasos junto con alteración sinusoide que lleva la hipoxia y por lo tanto neovascularización (10–12).
Definición DMAE
La degeneración macular relacionada con la edad es una enfermedad neurodegenerativa que afecta a la unión entre la retina neural y el epitelio pigmentario de la retina, sobre todo de la sexta a la novena década de la vida, cerca del 8,5% de todos los casos de ceguera en el mundo se deben a la degeneración macular relacionada con la edad sobre todo en los países industrializados (13). Una de las manifestaciones de la DMAE son las drusas, depósitos amarillos ubicadas entre el EPR y la membrana de Bruch (BM) están formadas por desechos extracelulares que se pueden presentar en algunos casos de manera fisiológica como el envejecimiento o patológica siendo un factor de riesgo que aumenta la probabilidad de desarrollar DMAE en estadios tempranos sin ser la causa (10,11)
Tipos de DMAE
DMAE no exudativa “seca”
La DMAE seca es el primer estadio de la patología y se describe como una pérdida progresiva e indolora de la visión central. En la DMAE seca hay presencia de drusas que pueden ser drusas pequeñas o duras, drusas grandes o blandas, cuticulares, reticulares, calcificadas y las drusas blandas tienen bordes irregulares y están mal definidas, diferentes estudios y ensayos indican que las drusas grandes, blandas y confluentes están relacionadas con la edad y se asocian con un mayor riesgo de desarrollar DMAE avanzada con neovascularización (14,15).
Drusas cuticulares
Este tipo de drusas están entre la membrana de Bruch (BM) y el EPR, las drusas cuticulares son múltiples y se ven por primera vez en la periférica, posteriormente en la macula. Tienen forma de estrella, son hiperfluorescentes, pueden confundirse con drusas pequeñas, pero deben diferenciarse porque tienen apariencia de sierra con forma triangular (11).
Drusas calcificadas
Las drusas pueden calcificarse cuando duran por un periodo largo de tiempo, cuando estas se encuentran existe la probabilidad del 26% de desarrollar atrofia geográfica en 5 años aproximadamente. Tienen un aspecto brillante y se puede identificar como drusas hiperreflectantes (11).
Atrofia geográfica
La atrofia geográfica (AG) se da por la pérdida de fotorreceptores en el EPR y coriocapilar subyacente, representa del 35% al 40% de los casos de DMAE en etapa tardía y afecta principalmente a personas> 85 años. Las variantes genéticas, así como factores modificables en donde se incluye el tabaquismo y la baja ingesta de ácidos grasos omega-3, son conocidos por estar asociados con mayores tasas de progresión a la AG. Las lesiones ocasionadas llevan a la pérdida de visión progresiva central y suele ser bilateral, se localizan en primera instancia en la retina perifoveal afectando la lectura, conducción y la visión con poca luz, posteriormente afecta el centro foveal comprometiendo la agudeza visual central. No existe un tratamiento definido por lo tanto enfatiza aún más el impacto de la AG en el envejecimiento de la población y subraya la necesidad de una estrategia eficaz para prevenir y retrasar la enfermedad.
En la DMAE seca tardía la atrofia geográfica es un signo determinante que se caracteriza por presentar placas confluentes, uniformes de contornos irregulares y muy bien definidos los cuales permiten diferenciar muy bien la retina sana de la retina atrófica, hay despigmentación que se presenta de forma completa o incompleta en el que se evidencia un adelgazamiento del tejido subyacente donde se pueden observan los vasos de la coroides. Su tamaño varía entre uno y tres diámetros papilares, aunque en algunos momentos pueden llegar a tamaños mayores y pueden alcanzar las arcadas temporales de la retina. El área mínima para que se considere atrofia geográfica es de 175 micras (16–19).
DMAE húmeda o neovascular
Este tipo de degeneración resulta más grave que la DMAE seca, se presenta cuando los vasos anormales de la retina empiezan a crecer en la mácula, una estructura en donde no deberían existir, estos vasos se caracterizan por ser muy débiles dando origen a sangrados, por lo que el daño de la macula se produce rápidamente además en la DMAE húmeda se pierde muy rápido la visión central, esta etapa se caracteriza por desprendimiento seroso del EPR y la presencia de neovascularización coroidea clásica (NVC) que se clasifica según la localización con el centro de la fóvea, en extrafoveal (>200 µm. del centro), yuxtafoveal (a una distancia de 1 -199 µm del centro o subfoveal (exactamente debajo del centro) (20,21)
Tabla 1. Clasificación activa e inactiva de la Degeneración Macular Asociada a la edad neovascular.
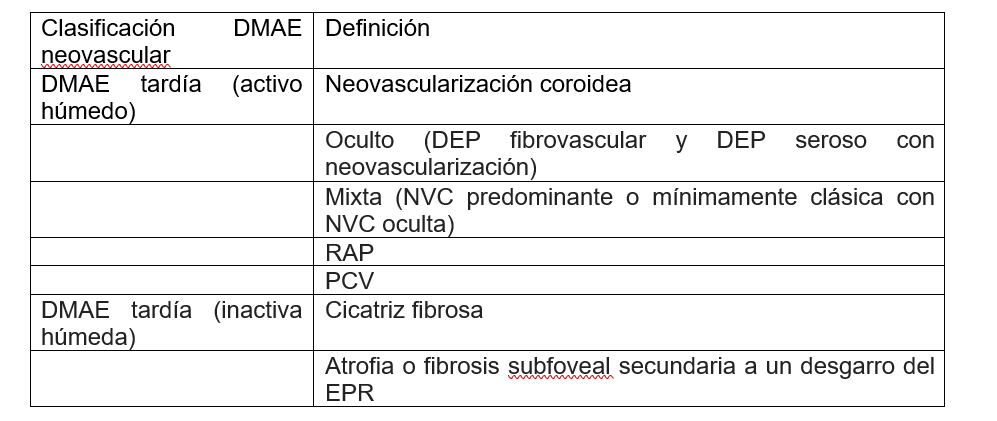
Evolución natural de la enfermedad
En la DMAE los primeros signos visibles son las drusas ubicadas entre el epitelio pigmentario de la retina (EPR) y la membrana de Bruch (BM), se caracterizan por tener un aspecto amarillo blanquecino y se pueden clasificar según el número, tamaño de forma y distribución (5).
Las drusas duras pequeñas son uniformes de color blanco brillante, contorno nítido y con un diámetro menor a 63 µm, son frecuentes en individuos jóvenes y adultos, en el 90% de las fotografías de fondo de ojo se pueden observar, no representan un factor de riesgo para desarrollar DMAE con una probabilidad baja (0,4%) pero si hay muchas drusas duras pequeñas se pueden asociar con el desarrollo posterior de las drusas blandas que son determinantes para el desarrollo de la patología. Existen factores de riesgo para el desarrollo de las drusas duras pequeñas como; la edad, niveles altos de triglicéridos séricos y niveles más bajos de colesterol de lipoproteínas de alta densidad (11,14,22).
Las drusas medianas o intermedias miden más de 63 μm y menos de 125 μm tienen una probabilidad entre el 2% y 20% de desarrollar DMAE tardía dentro de cinco años. Las drusas grandes o blandas son de color blanco amarillentas, mal definidas y miden más de 125 μm, aumentan de tamaño rápidamente, se hacen más abundantes y con el tiempo tienen mayor riesgo de migración de células del EPR sobre la drusa llevando al colapso y formación de GA también se pueden generar uniones o generando una elevación localizada del EPR o «desprendimiento drusoide del EPR». Cuando aparecen drusas grandes en ambos ojos se relaciona entre un 13% y 47% de riesgo de progresión a DMAE avanzada a los 5 años, pero, si adicionalmente aparecen anomalías pigmentarias bilaterales, el riesgo puede aumentar hasta cerca del 50% (11,23).
Pseudodrusas o drusas reticulares (RPD) se conocen como depósitos sub retinianos en forma de puntos que se localizan entre el EPR y la capa de fotorreceptores, es decir por encima del nivel pigmentario de la retina debido a esto aparecen por primera vez en la parte superior retinal y con el tiempo se extienden hacia la macula formando redes entrelazadas. Aparecen con poca frecuencia en individuos sin patología alguna sin embargo sus tasas más altas de aparición están directamente relacionadas con la degeneración macular relacionada con la edad (DMAE) (11,24)
Un hallazgo importante son las anomalías pigmentarias denominadas hiperpigmentación e hipopigmentación cuando no se asocian a otras enfermedades retinianas, va a existir una mayor probabilidad de que se incremente la de DMAE, la distrofia viteliforme foveomacular se da inicialmente en el adulto, es una enfermedad macular que se considera poco común, inicialmente descrita por Gass en 1974. Esta anomalía está asociada con alto riesgo de progresión de la degeneración macular relacionada a la edad, se generan drusas grandes (125 micrómetros o más) con anormalidades pigmentarias. Las Drusas reticulares con anormalidades pigmentarias o lesión viteliforme sin perdida visual significativa (agudeza mejor corregida que 6/18) o Atrofia menor de 175 micrómetros y que no afecta la fóvea (23,25).
En la DMAE intermedia hay degeneración y disfunción del EPR con presencia de cambios degenerativos subretinianos en ausencia de neovascularización y desprendimiento epitelial del pigmento seroso sin neovascularización (26). En la DMAE húmeda hay neovascularización coroidea clásica (NVC), proliferación angiomatosa retiniana (RAP) que puede ser una variante de DMAE en la cual el principal elemento del complejo neovascular se ubica inicialmente dentro de la retina. El proceso puede producir en el plexo capilar retiniano profundo o en la coroides (23). La vasculopatía coroidea polipoidea (VCP), aún se encuentra clasificada como un subtipo de degeneración macular asociada a la edad exudativa (DMAEE), es una versión con neovascularización subretiniana, cuyo rasgo característico es la existencia de una angiogénesis patológica que se localiza debajo del epitelio pigmentario de la retina (EPR) (27).
LA DMAE tardía (inactiva húmeda) se caracteriza por presencia de: cicatriz fibrosa, Atrofia o fibrosis subfoveal secundaria a un desgarro del EPR, Atrofia (ausencia o adelgazamiento del EPR y / o retina), Degeneración quística (líquido intrarretiniano persistente o tubulaciones que no responden al tratamiento), es importante tener en cuenta que los ojos aún pueden desarrollar o tener una recurrencia de DMAE tardía (activo húmedo) (28). En la neovascularización macular tipo 1 (MNV tipo 1) se presenta un crecimiento interno de vasos que empieza desde la coroides y permanecen debajo del EPR con expansión de la lesión y crecimiento vasculares que puede conllevar a formación de tejido fibrótico ya que el crecimiento de los vasos sanguíneos va acompañado de células como macrófagos, fibroblastos y miofibroblastos. Al examinar con angiografía existe hiperfluorescencia, si hay una ruptura de la barrera externa puede generar exudación hacia el espacio subretiniano (28). En el tipo 2 MNV hay una proliferación nueva de vasos procedentes desde la coroides hacia el espacio subretinianos, estrías anigiodes, estrías de laca y coriorretinitis. En la angiografía con fluoresceína se ve una fuga tardía pero con hiperfluorescencia temprana, con el OCT hay una red neovascular que está por encima del EPR (28). Cuando hay Neovascularización tipo 3, en el plexo capilar empieza la proliferación vascular hacia la retina externa. En este tipo de Neovascularización, ya hay presencia de edema y hemorragias puntiformes en la mácula, el oct muestra el edema en la capa nuclear interna y líquido subretiniano y la angiografía fluoresceínica se ve la acumulación de colorante en espacios cistoides e hiperfluorescencia (28).
Epidemiología
La DMAE es una de las principales causas de discapacidad visual en todo el mundo, el envejeciendo aumenta a medida que las personas viven más tiempo y se espera que el número de personas mayores en los Estados Unidos se duplique en los próximos 30 años, entonces habrá más población con esta enfermedad, ahora hay aproximadamente 2 millones de personas con pérdida visual debido a DMAE en los Estados Unidos, y esto aumentará a aproximadamente 5 millones en unas pocas décadas la prevalencia global de AMD se estima en 196 millones de personas afectadas, y se prevé que esta carga de enfermedad aumente en un 40%, a 288 millones para el 2040 por lo tanto la DMAE se ha denominado epidemia (29). Se encontró que la incidencia acumulada de 5 años de DMEA temprana aumentó de 3.9% en individuos de 43 a 54 años a 22.8% en personas de 75 años y mayores, la incidencia global de 5 años de DMAE tardía fue de 0.9%, Las personas de 75 años de edad o mayores tuvieron una tasa de incidencia de 5.4% de DMAE tardía y la incidencia general de DMAE temprana fue de 17.3% en esta población de participantes de 40 años o más (30).
Factores de riesgo en la DMAE
La DMAE es de etiología multifactorial y se cree que responde a una compleja interacción entre factores poligénicos, de estilo de vida y ambientales, al conocer que factores están asociados a la enfermedad y son modificables se puede reducir el riesgo, uno de estos es dejar de fumar o no hacerlo y adoptar una dieta saludable puede ser de gran importancia. Según la Academia Americana de Oftalmología en pacientes con un alto riesgo de desarrollar DMAE húmeda en etapa tardía el oftalmólogo únicamente puede recetar la toma de suplementos dietéticos ya que se ha demostrado puede reducir un 25% de riesgo de la patología (30,31).
Factores personales
La edad es el principal factor de riesgo de la DMAE porque se asocia a los cambios que se producen en las estructuras retinales y predisponen al desarrollo de la patología.(11). Todos los estudios demuestran que la prevalencia, la incidencia y la progresión de todas las formas de AMD aumentan abruptamente con el aumento de la edad. Hubo un riesgo 17 veces mayor de AMD comparando el grupo de edad más antiguo con el más joven en el Estudio Framingham (30).
Raza / Etnia
Estudios multiétnicos realizados determinaron la prevalencia en las diferentes formas de la DMAE por grupos étnicos en donde la prevalencia en caucásicos es del 5.4 % (raza blanca) y el 2.4% de prevalencia en africanos (raza negra), las personas de raza blanca son más propensas a desarrollar DMAE seca en etapas tardías con mayor asociación a neovascularización coroidea comparado con pacientes de raza negra que tienen menor probabilidad de desarrollar DMAE sin embargo se han encontrado casos en estadio tardío con atrofia geografía, la correlación se debe a el grado de pigmentación ocular como un factor de protección y diferentes hipótesis plantean que el aumento de melanina en las células del epitelio pigmentario retinal (EPR) en las personas de raza negra esta melanina actúa como eliminador de radicales libres protegiendo la membrana de Bruch y células del EPR (11,32).
Clase social y nivel educativo
Se ha demostrado que los niveles más bajos de educación y de ingresos están más relacionados con una mayor morbilidad y mortalidad por una serie de enfermedades, hay hallazgos mixtos para DMAE. Hay estudios en donde se demuestra que a mayor nivel educativo hay una menor prevalencia de la patología (0.7 % en los individuos que han estudiado 12 años o pueden ser más y el 1% en los que han estudiado menos de 8 años) (30,33)
Grado de pigmentación del iris
En diferentes estudios se ha detectado que existe una correlación entre la DMAE y el color claro del iris. En las personas que tienen los ojos con iris de color claro como el azul hay una incidencia dos veces mayor de desarrollar DMAE en comparación con aquellos que tienen un color de iris oscuros como es el caso del marrón, su relación se debe a que los niveles más altos de melanina ocular pueden proteger contra el daño oxidativo inducido por la luz en la retina (30,34,35).
Hipermetropía
De acuerdo con la asociación entre la DMAE y el error de refracción en pacientes con hipermetropía se demostró que los ojos con relaciones copa-disco más grandes tenían un riesgo reducido de DMAE exudativa sin embargo los resultados de algunos estudios sugieren que la asociación solo puede aplicarse a la DMAE que sean de estadios tempranos (30).
Factores sistémicos
Dieta rica en grasas
Los factores dietéticos reducen el estrés oxidativo y la inflamación que se puede asociar a la DMAE y en caso de que se reciba una alta ingesta de ciertas grasa como las grasas saturadas, se ha asociado con el aumento doble en la prevalencia de la DMAE, aunque si hay mayor consumo de las grasas monoinsaturadas estas resultan potencialmente protectoras (36).
Consumo de tabaco
Fumar es el principal factor de riesgo que puede ser modificable, y por esta razón se debe alentar a los pacientes en cada visita a que deben dejar de fumar para evitar una mayor pérdida visual, los fumadores mayores de 40 años tienen de dos a cuatro veces más probabilidades de desarrollar DMAE que los no fumadores de la misma edad, si durante 20 años no se fuma hay una similitud con los no fumadores, denotando que hay reducción en el riesgo de desarrollar DMAE , el humo de cigarrillo se asocia al estrés oxidativo en la retina (3,11)
Factores familiares
Tendencias genéticas
En amplios estudios de asociación de genomas se ha evidenciado que existen más de 30 genes asociados los cuales tienen el riesgo de desarrollar DMAE, estos estudios han determinado que se presenta en personas que tienen ciertas afecciones, se dice que el gen se asocia con la afección y existen dos genes que se han relacionado más estrechamente a generar degeneración macular.
Estos son:
La cascada de complemento (grupo de genes) en el cromosoma 1; y
Los genes ARMS2/HTRA en el cromosoma 10
Estas variantes significan que existe mayor posibilidad de desarrollar DMRE a un nivel avanzado de la enfermedad en el futuro (37). La genética está muy asociada a la DMAE avanzada, la enfermedad de sorsby es una distrofia macular autosómica dominante con depósitos de proteínas debajo del EPR (drusas) al igual que en la DMAE la distrofia de sorsby es causada por la variación del gen para el inhibidor tisular de metaloproteinasas-3 (TIMP3) donde hay implicación de perdida y ganancia de cisteína, en base a su similitud en la DMAE se encontró un locus establecido y variantes de TIMP3 con un riesgo de enfermedad 30 veces mayor (38).
Factores ambientales
Exposición a la radiación ultravioleta
La exposición ocular a la radiación óptica está relacionada principalmente con la radiación solar y, en consecuencia resultan más afectados los trabajadores expuestos al aire libre, especialmente si trabajan en superficies que son capaces de reflejar la radiación óptica, como agua, arena blanca, nieve o metales brillantes, como el ojo está anatómicamente bastante protegido de los rayos solares que provienen del cielo (39).
Exposición a la luz azul
El Schepens Eye Institute informa que “los rayos azules del espectro parecen acelerar la DMAE más que otros rayos del espectro” .La retina está expuesta a la luz azul y se ha demostrado que daña el EPR de la retina la coriocapilar por medio de la generación de ROS en pacientes con DMAE es estadios tempranos porque el cristalino es transparente y no puede filtrar esta radiación, a diferencia de pacientes de mayor edad con DMAE que tiene un cristalino amarillo y filtran la longitud de onda su asociación se da por niveles más bajo de antioxidantes (40,41).
Síntomas del paciente con DMAE
Es importante conocer los primeros síntomas en los pacientes con DMAE porque en los primeros estadios estos pueden pasar inadvertidos, es necesario una remisión rápida al especialista quien determinará la evaluación y el tratamiento oportuno dependiendo de la etapa de la enfermedad, los primeros síntomas son visión borrosa con dificultad para realizar tareas cercanas central como ver televisión, leer, usar el celular, disminución progresiva de la visión o de forma repentina que no mejora con la mejor corrección visual, metamorfopsias, micropsias, micropsias, la visión cromática puede estar alterada, así como problemas para adaptarse a la oscuridad, mala visión en penumbra, persistencia de postimágenes. y dificultades para hacer actividades cotidianas como reconocer a las personas, bajar las escaleras y defectos del campo central de tipo absoluto o relativo, los pacientes lo describen como algo que tapa la parte central de su visión, esto es un síntoma patológico grave (20,42).
Diagnóstico de la DMAE
Agudeza visual
En la DMAE se genera una disminución significativa de la AV central, esto se presenta de manera lenta, la cual se caracteriza por cursar de manera progresiva en la forma atrófica y de forma rápida en la húmeda. Esta anomalía suele ser bilateral, pero también puede producirse monocular y así pasar desapercibida si se presenta la afectación poco significativa en el otro ojo, permitiendo que no se genere un diagnóstico oportuno. El test Gold Estándar para medir la A.V en adultos es el estudio de retinopatia diabetica tratamiento temprano (ETDRS) (43). La agudeza visual mejor corregida de cualquier clasificación según diferentes estudios en promedio es de 0.6165 esto en escala LogMAR y convertido en 20/80 en Snellen. Según cifras en 43% de los casos de degeneración macular asociada a la edad dentro del tipo neovascular la agudeza visual mejor corregida arroja valores menores o iguales a 20/200 y pasado a escala LogMAR 1.0 es importante tener en cuenta que esto corresponde a la ceguera legal (2).
Sensibilidad al contraste
La sensibilidad al contraste (SC) es muy importante ya que es una parte diagnostica y pronostica fundamental para el análisis clínico de la función visual, en algunos trastornos oculares neurodegenerativos como la DMAE se ha comprobado que esta se encuentra disminuida. La sensibilidad al contraste podría estar afectada antes que la AV por lo tanto en ciertos estadios de la enfermedad puede subestimar el inicio y gravedad de la discapacidad visual, se debe hacer una prueba de SC para un diagnóstico temprano (4).
Tomografía de coherencia óptica (OCT)
La tomografía de coherencia óptica (OCT) es una técnica no invasiva que se realiza para obtener imágenes de tejidos transversales, se utiliza luz que se encuentra en un rango cercano de luz infrarrojo, tiene una profundidad de cientos de micrones en el tejido. Esta técnica es especialmente valiosa en órganos donde el diagnóstico de tejido microscópico tradicional mediante biopsia no es posible, como el ojo humano. Debido a que el OCT no es una técnica invasiva, permite obtener imágenes in vivo sin generar afecciones en el tejido del que se generan las imágenes. Las velocidades de escaneo son rápidas y el procesamiento de la señal es rápido por lo que esto permite visualizar imágenes en tiempo real y a velocidad de video (44).
En la actualidad se considera que el OCT es el gold standard para el diagnóstico de DMAE; siendo esto aceptado por los médicos especialistas, por lo que se decidió formular una recomendación a favor del (OCT) como prueba diagnóstica confirmatoria en personas con DMAE húmeda (45). Con este examen se puede monitorear la progresión de la DMAE temprana a formas graves, como la atrofia geográfica (14).
Evaluación al color en pacientes con DMAE
El Gold standart para la evaluación del color se denomina anomaloscopio, un test con alto costo que requiere una destreza muy precisa y su implementación en la clínica diaria es complicada, por esto se pueden usar otros test para examinar la visión del color en los pacientes con DMAE como el farnsworth, una prueba diagnóstica importante que se utiliza para definir el grado de defectos hereditarios de la visión del color, esta prueba permite la evaluación cuando existe visión del color deficiente por trastornos adquiridos (46,47).
Examen de fondo de ojo con dilatación pupilar
Aunque no fue posible determinar la precisión diagnóstica del examen clínico al no haber sido comparado con un Gold standard; se consideró que en la actualidad el examen clínico es la prueba de referencia para diagnosticar DMAE, siendo esto aceptado por los médicos especialistas, por lo que se decidió formular una recomendación a favor del examen de fondo de ojo con dilatación pupilar como prueba diagnóstica confirmatoria en pacientes con DMAE no exudativa (6).
Angiografía con fluoresceína
La angiografía con fluoresceína (AF) es una prueba fundamental para observar la vasculatura retinal donde se puede detectar vasculitis coroidea, isquemia y otras lesiones, se deben usar tintes intravenosos separados como la fluoresceína y verde de indocianina para el edema macula. Previo al el examen al paciente debe tener su dato de creatinina para saber si puede ser inyectado el tinte de fluoresceína por vía intravenosa, debe estar en ayunas y bajo dilatación pupilar, para registrar la progresión del tinte se pone un filtro azul cobalto en el equipo y se toman fotografías que evidencian el paso de la fluoresceína a través de la vasculatura de la coroides y retina, si hay presencia de anomalías se podrán ver áreas hiperfluorescentes que significan acumulación de la fluoresceína o hipofluorescentes en ausencia de este (48).
Angiografía con verde de indocianina (vic)
En la angiografía se administra verde de indocianina por vía intravenosa y se utilizan filtros próximos al infrarrojo. En esta técnica la luz puede atravesar los pigmentos oculares de exudados y las capas finas de sangre subretiniano, lo que permite observar la vasculatura coroidea; esta prueba diagnóstica se puede emplear en pacientes que presentan opacidades oculares debido a que a luz infrarroja se dispersa en menor cantidad que la visible y la angiografía con verde indocianina tiene mayor resolución ya que las proteínas libres quedan atrapadas dentro de los vasos coroideos.es importante mencionar que si se llega a presentar un efecto adverso con esta técnica suelen ser muy graves (1).
Estrés oxidativo
Muchas patologías están asociadas a la edad debido al estrés oxidativo que incrementa con el envejecimiento, y se asocia a la disminución de los antioxidantes encargados de la protección contra los oxidantes, esto genera efectos nocivos en las células como la peroxidación lipídica, modificación oxidativa de proteínas y ácidos nucleicos. El cambio en el equilibrio antioxidante/oxidante no siempre es malo porque es un proceso fisiológico celular pero si hay un desequilibrio porque no hay suficientes antioxidantes que protejan contra las diferentes fuentes oxidantes puede llevar a la afección de estructuras como la retina (49).
Estrés oxidativo y asociación retinal
Los ojos son estructuras muy susceptibles al estrés por la alta exposición a la luz visible, el alto consumo de oxígeno, la proximidad anatómica a la coriocapilar, procesos como la fagocitosis del segmento externo de los fotorreceptores son la principal fuente en la producción de radicales libres porque contienen muchos ácidos grasos poliinsaturados por esto para proteger los tejidos retinales es necesario un sistema antioxidante eficaz que proteja frente a la exposición continua de las especies reactivas de oxígeno (50,51).
Glutatión
El glutatión (GSH) es un tripéptido importante para todos los tejidos, se encuentra mayormente en el hígado, los riñones incluida la retina se encuentra presente en el citosol en un 80 a 85 % y en las mitocondrias de un 10 a 15 %, es fundamental para la desintoxicación de toxinas extrañas, se encarga de proteger las células del estrés oxidativo dañino, mantiene el equilibrio redox y regula la función del sistema inmunológico (52,53). Un factor a destacar es que el estrés oxidativo crónico afecta a todos los sistemas fisiológicos del organismo dando lugar a la pérdida progresiva de la homeostasis en la salud porque aumenta la producción de oxidantes y/o disminución de los sistemas de defensas antioxidantes, que da como resultado un aumento del daño oxidativo en las biomoléculas tales como (lípidos, proteínas, ADN), lo que explica el deterioro de la funcionalidad celular asociado al avance de la edad (54). La deficiencia del GSH en la edad avanzada es mayor, se asocia a el estrés, enfermedades, genética, el sexo o los factores ambientales, esto genera que las células o los orgánulos estén expuestos a daño tisular y este a su vez se asocia a la progresión de muchos trastornos oculares como; la DMAE, glaucoma, neuropatía óptica hereditaria de leber y la retinopatía diabética ya que muchas enfermedades crónicas se asocian con niveles disminuidos de este tripéptido lo que se busca es aumentar la reserva de GSH para prevenir o evitar la progresión estas patologías (53).
Debido a la función protectora frente al estrés oxidativo existe la necesidad de mantener reservas de GSH altas en todas las células, se puede lograr con la ingesta de salmón que contiene ácidos grados omega-3, la ingesta de frutas, verduras, alimentos verdes espárragos, aguacate, pepino, judías verdes y espinacas que reduce el estrés oxidativo. Algunos estudios en animales podrían indicar que algunas hierbas y raíces como; el romero, la cúrcuma y Ginkgo biloba puede influir en los niveles de GSH (55).
BIBLIOGRAFIA
- Abokyi S, To CH, Lam TT, Tse DY. Central Role of Oxidative Stress in Age-Related Macular Degeneration: Evidence from a Review of the Molecular Mechanisms and Animal Models. Oxidative Medicine and Cellular Longevity. 2020 Feb;2020:1.
- García-Montalvo IA, Matías-Pérez D. Componentes nutricionales y degeneración macular relacionada con la edad. Nutr Hosp [Internet]. 2015;32(1):50–4. Available from: http://scielo.isciii.es/pdf/nh/v32n1/08revision06.pdf
- Al-Zamil WM, Yassin SA. Recent developments in age-related macular degeneration: A review. In: Clinical Interventions in Aging [Internet]. Dove Medical Press Ltd.; 2017 [cited 2020 May 5]. p. 1313–30. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5573066/
- Muñoz-Ramón P V., Hernández Martínez P, Muñoz-Negrete FJ. New therapeutic targets in the treatment of age-related macular degeneration. Arch Soc Esp Oftalmol. 2020;95(2):75–83.
- Fernández-Araque A, Aranda AG, Pardos CL, Rojo Aragüés AA. Los antioxidantes en el proceso de patologías oculares. Nutr Hosp. 2017;34(2):469–78.
- Boyd S. Anatomía y Fisiología del vítreo y la retina. Man Retin SERV [Internet]. 2013;1–7. Available from: https://www-clinicalkey-es.ezproxy.unbosque.edu.co/service/content/pdf/watermarked/3-s2.0-B9788491135647500064.pdf?locale=es_ES&searchIndex=
- Ma L, Liu R, Du JH, Liu T, Wu SS, Liu XH. Lutein, zeaxanthin and meso-zeaxanthin supplementation associated with macular pigment optical density. Nutrients. 2016;8(7).
- Evans M. Anatomía de la úvea- ClinicalKey. Oftalmologia. 2020.
- Ehrlich R. Anatomy and Regulation of the Optic Nerve Blood Flow q. Reference Module in Neuroscience and Biobehavioral Psychology. Elsevier; 2017. 1–11 p.
- Porter D. ¿Whar are drusen? American Academy of Ophthalmology. 2020. p. 1.
- Hoyng CB, Lechanteur YTE. Risk factors for progression of age-related macular degeneration. 2020;40:140–70.
- García-Layana A, Cabrera-López F, García-Arumí J, Arias-Barquet L, Ruiz-Moreno JM. Early and intermediate age-related macular degeneration: Update and clinical review. Clin Interv Aging. 2017;2017:12:1579–87.
- Bao KC. Oftalmología Médica II El Ojo y Las Enfermedades Sistémicas. 2017 Elsev. :1–8. Available from: https://www-clinicalkey-es.ezproxy.unbosque.edu.co/service/content/pdf/watermarked/3-s2.0-B9788491130338004237.pdf?locale=es_ES&searchIndex=
- Gheorghe A, Mahdi L, Musat O. Age-Related Macular Degeneration. Rom J Ophthalmol. 2015;59(2):74–7.
- Ear, nose and throat and eye disease- ClinicalKey. 2021.
- Cruz Gonzales F. Estudio clínico y genético de la degeneración macular asociada a la edad. Ediciones universidades de salamca. 2012. p. 14–20.
- Fleckenstein M, Mitchell P, Freund KB, Sadda SV, Holz FG, Brittain C, et al. The Progression of Geographic Atrophy Secondary to Age-Related Macular Degeneration. Vol. 125, Ophthalmology. Elsevier Inc.; 2018. p. 369–90.
- Schmitz-Valckenberg S. The Journey of “Geographic Atrophy” through Past, Present, and Future. Ophthalmologica. 2017 Feb;237(1):11–20.
- Merle BMJ, Silver RE, Rosner B, Seddon JM. Dietary folate, B vitamins, genetic susceptibility and progression to advanced nonexudative age-related macular degeneration with geographic atrophy: a prospective cohort study. Am J Clin Nutr. 2016 Apr;103(4):1135–44.
- Fritsche LG, Igl W, Bailey JNC, Grassmann F, Sengupta S, Bragg-Gresham JL, et al. A large genome-wide association study of age-related macular degeneration highlights contributions of rare and common variants. Nat Genet. 2016 Feb;48(2):134–43.
- Reim M, Kirchhof B, Wolf S. Examen Del Fondo De Ojo/ Exam of the Rear of the Eye: Desde Los Hallazgos Hasta El Diagnostico/ from the Findings to the Diagnostic. 2005;250.
- Munch IC, Li XQ, Ahmad SSM, Olsen EM, Skovgaard AM, Larsen M. Small hard macular drusen and associations in 11- to 12- year-old children in the copenhagen child cohort 2000 eye study. Investig Ophthalmol Vis Sci. 2019 Apr;60(5):1454–60.
- Salmon MD, FRCS, FRCOphth JF. Kanski’s Clinical Ophthalmology, Ninth Edition. In: Salmon MD, FRCS, FRCOphth JF, editor. 2020. p. 555–613.
- Wightman AJ, Guymer RH. Reticular pseudodrusen: current understanding. Clin Exp Optom. 2019;102(5):455–62.
- Wilde C, Awad M, Giannouladis K, Lakshmanan A, Yeung AMH, Dua H, et al. Natural course of adult-onset vitelliform lesions in eyes with and without comorbid subretinal drusenoid deposits. Int Ophthalmol [Internet]. 2020;40(6):1501–8. Available from: https://doi.org/10.1007/s10792-020-01319-2
- Gale RP, Mahmood S, Devonport H, Patel PJ, Ross AH, Walters G, et al. Action on neovascular age-related macular degeneration (nAMD): recommendations for management and service provision in the UK hospital eye service. Vol. 33, Eye (Basingstoke). Springer Nature; 2019.
- Inoue M, Balaratnasingam C, Freund KB. Optical coherence tomography angiography of polypoidal choroidal vasculopathy and polypoidal choroidal neovascularization. Retina. 2015 Oct;35(11):2265–74.
- Spaide RF, Jaffe GJ, Sarraf D, Freund KB, Sadda SR, Staurenghi G, et al. Consensus Nomenclature for Reporting Neovascular Age-Related Macular Degeneration Data: Consensus on Neovascular Age-Related Macular Degeneration Nomenclature Study Group. Ophthalmology. 2020;127(5):616–36.
- Seddon JM. Macular degeneration epidemiology: Nature-nurture, lifestyle factors, genetic risk, and gene-environment interactions – the weisenfeld award lecture. Investig Ophthalmol Vis Sci [Internet]. 2017 Dec 1 [cited 2020 May 3];58(14):6513–28. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5749242/
- Seddon JM, Sobrin L. Epidemiology and Risk Factors for Age-Related Macular Degeneration. Sixth Edit. Vol. 2, Retina Fifth Edition. Elsevier Inc.; 2012. 1134–1144 p.
- Turbert David. Los 5 factores de riesgo principales para la DMRE – American Academy of Ophthalmology. 2019.
- Chakravarthy U, Wong TY, Fletcher A, Piault E, Evans C, Zlateva G, et al. Clinical risk factors for age-related macular degeneration : a systematic review and meta-analysis. BMC Ophthalmol. 2010;13.
- García-Layana A, Sainz Gómez C, Fernández Robredo P, Rodríguez Fernández JA. Lípidos y degeneración macular asociada a la edad. Arch Soc Esp Oftalmol. 2001;76(7):395–6.
- Lambert NG, Elshelmani H, Singh MK, Mansergh FC, Wride MA, Padilla M, et al. Progress in Retinal and Eye Research Risk factors and biomarkers of age-related macular degeneration. Prog Retin Eye Res. 2016;54:64–102.
- Garakani R, Ng JS. Associations between macular pigment, iris color and reflectance, ethnicity, and color vision: An observational study. PLoS One [Internet]. 2019 [cited 2020 May 3];14(8). Available from: https://search-proquest-com.ezproxy.unbosque.edu.co/pq1academic/docview/2270189315/DDEBF89FCBA442ACPQ/11?accountid=41311
- Parekh N, Voland RP, Moeller SM, Blodi BA, Ritenbaugh C, Chappell RJ, et al. Association between dietary fat intake and age-related macular degeneration in the Carotenoids in Age-Related Eye Disease Study (CAREDS): An ancillary study of the women’s health initiative. Arch Ophthalmol. 2009 Nov;127(11):1483–93.
- Mukamal Reena. La genética y la degeneración macular relacionada con la edad – American Academy of Ophthalmology [Internet]. 2019 [cited 2020 May 3]. Available from: https://www.aao.org/salud-ocular/consejos/la-genetica-y-la-degeneracion-macular
- Genet N. HHS Public Access. 2016;48(2):134–43.
- Modenese A, Gobba F. Macular degeneration and occupational risk factors: a systematic review. Int Arch Occup Environ Health [Internet]. 2019 Jan 3 [cited 2020 May 3];92(1):1. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6323067/
- Fletcher AE, Bentham GC, Agnew M, Young IS, Augood C, Chakravarthy U, et al. Sunlight exposure, antioxidants, and age-related macular degeneration. Arch Ophthalmol. 2008 Oct;126(10):1396–403.
- Ultra-violet and Blue Light Aggravate Macular Degeneration. American Macular Degeneration Foundation.
- García-Layana A, Cabrera-López F, García-Arumí J, Arias-Barquet L, Ruiz-Moreno JM. Early and intermediate age-related macular degeneration: Update and clinical review. Clin Interv Aging. 2017 Oct;12:1579–87.
- Rodríguez-Vallejo M, Llorens-Quintana C, Furlan WD, Monsoriu JA. Visual acuity and contrast sensitivity screening with a new iPad application q. Displays. 2016;44:15–20.
- Aumann S, Donner S, Fischer J. High Resolution Imaging in Microscopy and Ophthalmology. High Resolut Imaging Microsc Ophthalmol. 2019;59–85.
- Diagnóstico Y Tratamiento De La P EL. GUÍA DE PRÁCTICA CLÍNICA. 2019.
- Verriest G. Van Laethem J. UA. LEA Color Vision Testing [Internet]. [cited 2020 May 4]. Available from: www.good-lite.com%7C1.800.362.3860%7C1.888.362.2576fax
- Fanlo Zarazaga A, Gutiérrez Vásquez J, Pueyo Royo V. Review of the main colour vision clinical assessment tests. Arch Soc Esp Oftalmol. 2019;94(1):25–32.
- Krishna U, Ajanaku D, Denniston AK, Gkika T. Uveitis: A sight-threatening disease which can impact all systems. Postgrad Med J. 2017;93(1106):766–73.
- Daniel E Shumer NJNNPS. Oxidative stress response and Nrf2 signaling in aging Hongqiao. Physiol Behav. 2017;176(12):139–48.
- Sun Y, Zheng Y, Wang C, Liu Y. Glutathione depletion induces ferroptosis, autophagy, and premature cell senescence in retinal pigment epithelial cells article. Cell Death Dis [Internet]. 2018 Jul 1 [cited 2020 Oct 28];9(7). Available from: /pmc/articles/PMC6037763/?report=abstract
- Beatty S, Koh HH, Phil M, Henson D, Boulton M. The role of oxidative stress in the pathogenesis of age-related macular degeneration. Surv Ophthalmol. 2000;45(2):115–34.
- NCT01870193. Glutathione and Fuel Oxidation in Aging. Https://clinicaltrials.gov/show/nct01870193. 2013;
- Sreekumar PG, Ferrington DA, Kannan R. Glutathione Metabolism and the Novel Role of Mitochondrial GSH in Retinal Degeneration. Antioxidants 2021, Vol 10, Page 661. 2021 Apr;10(5):661.
- Muñoz Montero A. Cambios con el envejecimiento en parámetros de estrés oxidativo en células sanguíneas de hombres y mujeres. Rev Complut Ciencias Vet. 2017;11(1):113–9.
- Minich DM, Brown BI. A Review of Dietary (Phyto)Nutrients for Glutathione Support. Nutrients. 2019 Sep;11(9).





















